
Et lite paradigmeskifte innen DNA-kopiering
DNA-molekylet består av to kjeder av nukleotider satt sammen slik at molekylet minner om en vindeltrapp eller spiralformet stige. Dette kalles dobbelttrådet DNA. Hver av basene på den ene tråden er koblet til en base på den andre tråden, slik at de to sammen danner et basepar. Tenker vi oss at vi splitter stigen på langs, midt på trinnene, får vi to enkelttrådete DNA-tråder. Et enzym kalt DNA-polymerase leser så de individuelle trådene, finner ut hvilke baser som mangler, og setter disse sammen. Slik dannes den komplementære siden av stigen, og det som var én stige, har nå blitt til to.
Prosessen der DNA kopieres kalles replikasjon, foregår i alle levende vesener og danner grunnlaget for biologisk arv.
PCR
Slik replikasjon av DNA kan også foregå syntetisk. Å analysere DNA er nyttig av en rekke årsaker. Dette inkluderer diagnostisering og overvåkning av sykdommer, identifisering av kriminelle og til å studere funksjonen til et utvalgt stykke DNA. Disse analysene krever imidlertid ofte mer DNA enn forskeren har tilgjengelig. Å kopiere eller mangfoldiggjøre DNA er derfor nødvendig, men ikke alltid lettvint. Den mest brukte kopieringsmetoden bærer navnet polymerasekjedereaksjon eller PCR.
Utgangsmaterialet for polymerasekjedereaksjonen kalles templat-DNA, det vil si at en DNA-tråd virker som støpeform. Som templat er det nok med ett eneste DNA-molekyl som inneholder den sekvensen man ønsker å mangfoldiggjøre.
For å gjennomføre en PCR, må man først tvinge de to DNA-trådene fra hverandre. Dette gjøres ved å varme opp trådene til høy temperatur (93-98 °C). Trådene, som nå er skilt fra hverandre, blir deretter koblet til såkalte primere. Primere er syntetiske oligonukleotider og komplementære eller utfyllende til det området på templat-DNAet hvor disse skal feste seg. Når temperaturen senkes, finner og binder primerne seg til sine angitte mål, som stigtrinn i metaforen over. Ved å heve temperaturen igjen blir arbeidsvilkårene for DNA-polymerasen gode. Den gjør jobben sin, og en ny DNA-tråd dannes.
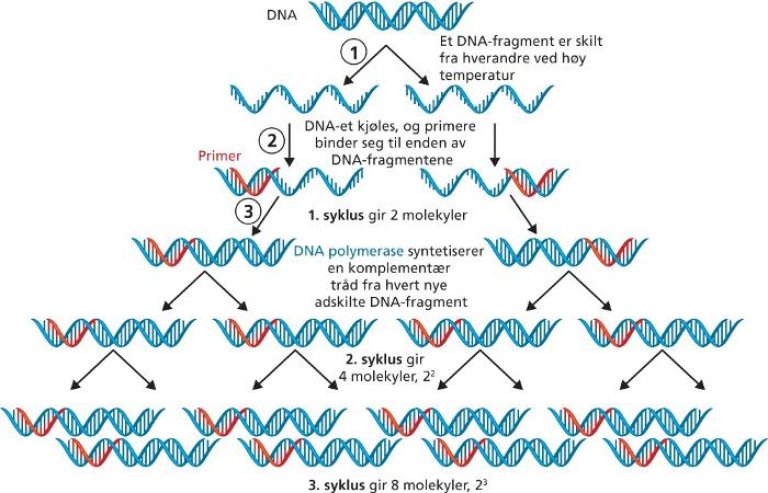
Til hver PCR trengs det to primere. En som er komplementær til starten av genet (forward) og en til slutten (revers). Området som er kopiert, avgrenses på hver side av plasseringen til de to primerne som har bundet seg til målet. En sentral regel i molekylærbiologien er at primerne kun skal være komplementære til målet – og ikke til hverandre. Dette for å unngå at primerne binder seg til hverandre – og ikke til målet de er designet for å feste seg til.
Et lite paradigmeskifte
Marc Anglès d'Auriac, seniorforsker ved Norsk institutt for vannforskning (NIVA), har i en nylig studie trosset denne regelen. I sitt arbeid for å artsbestemme henholdsvis laks, ørret og hybrider mellom disse, gikk Anglès d'Auriac bort fra hvordan PCR metoden tradisjonelt benyttes og beveget seg ut i ukjent terreng. Resultatet var et aldri så lite paradigmeskifte – og en ny-patentert metode som kan anvendes på en rekke andre områder der PCR benyttes. Studien er publisert i Open Access-tidsskriftet PLOS One.
Det Anglès d’Auriac viser i sin artikkel er at for å produsere DNA kan komplementaritet utnyttes ved å bruke asymmetriske konsentrasjoner, som kan forklares som ulikt antall molekyler i de ulike primerne. Navnet på metoden er ledende: COMplementary Primer ASymmetric PCR (COMPAS-PCR).
- Om du tilsetter et likt antall forward og revers primere i en PCR, og disse er komplementære til hverandre, vil de binde seg til hverandre, forklarer Anglès d’Auriac.
- Men tilsetter du ulikt antall, vil ikke primeren med et høyt antall molekyler finne andre primere å binde seg til, og den er således tilgjengelig for DNA-produksjon.
Tilnærmingen var langt fra intuitiv, men følgen er at primeren som ikke finner en partner begynner å jobbe på egenhånd; den lager enkelttrådet DNA. Når tilstrekkelig antall enkelttråder er produsert, kan de fungere som templat for primeren med lavt antall molekyler. Den frigjøres, og reaksjonen endres til tradisjonell eksponentiell produksjon.
Repeterende strukturer
I mange organismer er en betydelig del av den arvemessige informasjonen som er kodet inn i organismens DNA repeterende. Hos oss mennesker består over halvparten av DNA-sekvensene av repeterende elementer. Denne repeterende strukturen var det som fikk Anglès d’Auriac til å tenke utenfor boksen.
NIVA-forskeren skulle altså foreta artsbestemmelse mellom ørret, laks og hybrider mellom disse. Et lavt antall hybrider er naturlig i naturen, men når antallet hybrider øker er det et tegn på ustabilitet i økosystemet – forårsaket av for eksempel parasitter eller introduksjon av fremmede fiskearter. Disse hybridene kan være vanskelig å identifisere - og lett forveksles med en av de to foreldreartene. En rask og presis identifisering vil dermed bidra til å bedre både overvåkning og studier av økosystemet i elver. Etter først å ha funnet opp – deretter benyttet - COMPAS-PCR, kunne NIVA-forskeren ta i bruk en anerkjent metode kalt high resolution melt analysis for å skille de tre artene.
Anglès d’Auriac understreker imidlertid at COMPAS-PCR-prinsippet langt ifra er begrenset til identifikasjon av fiskearter. Å benytte komplementære primere kan fungere på alle repeterende elementer som ligger ved siden av hverandre i DNA-sekvenser av interesse.
- Repeterende DNA-strukturer er tilstede i en rekke genfamilier. Ved å utnytte disse strukturene, bidrar COMPAS-PCR til å utvikle nye strategier for DNA-produksjon, konkluderer Marc Anglès d’Auriac.